微生物组(Microbiome)是微生物在自然界中的存在形式,它们无处不在、无所不能,与我们每个人乃至海洋、土壤、大气的健康都息息相关。在微生物组的内部,不同种类的微生物之间存在着复杂、精妙的相互作用与影响,这一跨物种的细胞间代谢互作网络是群落功能和进化的基础。然而由于自然界中绝大部分微生物尚难以培养,而且细胞在纯培养状态往往无法体现其”原位”功能,因此“如何原位考察细胞间代谢互作”一直是微生物组方法学研究的重点与难点之一。近日,中国科学院青岛生物能源与过程研究所与牛津大学合作发明了“反向拉曼标记技术”,可在单细胞水平上示踪微生物群落中细胞代谢互作,为微生物组原位功能研究提供了新思路与新平台。该工作近期发表于《分析化学》(Analytical Chemistry)。
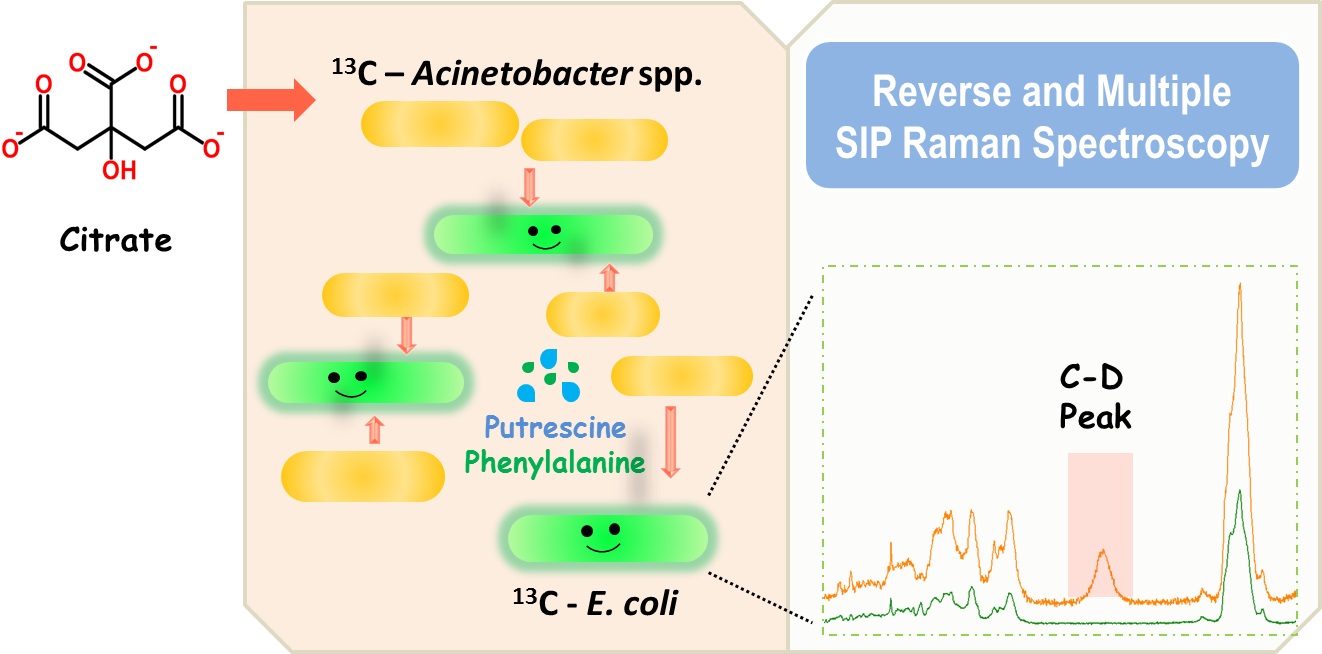
单细胞拉曼成像与活细胞稳定同位素标记相结合的技术,能分辨群落内代谢特定底物的细胞,从而重建“食物链”的时空特征。然而自然界中的底物种类几近无限,许多人们感兴趣的底物无法或难以用稳定同位素标记,这大大限制了该技术的应用。针对上述瓶颈,青岛能源所单细胞中心王允带领的研究小组打破了传统拉曼标记策略的思维定势,先使用13C标记的广谱碳源(如葡萄糖等)把群落中所有细胞都“喂饱”,再将碳源切换为未经标记的目标底物,然后通过观测单细胞拉曼光谱中目标底物代谢并替换细胞中13C标记化合物的过程,也就是测量13C拉曼峰反向漂移到12C位置的动态特征,从而分辨群落中特异性地代谢目标底物的细胞。同时,通过重水饲喂,观测2180 cm-1附近C-D峰的出现,以同时监测细胞的综合代谢活性。结合上述两种特性,可成像与重建细胞间的相互作用及底物传递过程(如图)。
单细胞中心等开发微生物组内部代谢互作示踪新技术
在此基础上,研究人员构建了由不动杆菌(Acinetobacter spp.)与大肠杆菌(E. coli)组成的模拟菌群,它们是人体、医院和自然界中均常见的机会致病菌,且其耐药性日益严重,已引起临床和微生物学者的关注。反向拉曼标记技术结合“碳源-重水”双标记实验发现,在柠檬酸作为唯一碳源的共培养体系中,不动杆菌可快速利用柠檬酸,并展现了较高的综合代谢活性。大肠杆菌“单身”时完全不能利用柠檬酸,但在与不动杆菌“同居”时却表现出了一定的综合代谢活性。代谢物组分析表明,在双方“同居”时,不动杆菌代谢柠檬酸的产物苯丙氨酸及腐胺可被大肠杆菌利用,含量虽不足以支撑后者的细胞分裂,但能保持其基础水平的综合代谢活性。因此该方法可在单细胞水平上解析与示踪群落中细胞之间的代谢互作与共生关系。
当前微生物组功能分析的主要工具,如元基因组、元转录组、元代谢组、稳定性同位素核酸探针(DNA/RNA-SIP)技术以及高通量培养技术等,通常难以揭示原位状态下群落中的各个成员在代谢功能上的互作关系。因此这一“反向拉曼标记技术”和双标记策略具备独特优势,有望作为一种共性手段与新工具,服务于人体健康、海洋生态、环境修复、生物发酵等广泛领域的微生物组研究。
上述工作由英国牛津大学工程系黄巍和中科院青岛能源所单细胞中心徐健联合主持,获得了基金委、中科院土壤微生物先导专项和中科院生物高通量检测分析服务网络(STS)等项目的支持。














 鲁公网安备37021202001515
鲁公网安备37021202001515


